
在A-Level化学考试中,一般都会遇到很多有关分子和原子等方面的知识点,接下来,我们跟随锦秋宋词佳来看一下分子间作用力知识点及相关题目的解题技巧。
分子间作用力(intermolecular force)在教材中是与化学键(chemical bond)放在一起学习的,再加上分子间作用力中常用的一种力名为“氢键”,所以很多同学都无法正确区分分子间作用力与化学键的概念,在考试应用中更是无从下手。
化学键分为金属键(metallic bond)、共价键(covalent bond)、离子键(ionic bond)三种,其中金属原子通过金属键直接形成giant metallic lattice/structure,电负性差值(difference in electronegativity, ΔEN)较大的元素通过离子键直接形成giant ionic lattice,电负性差值较小的元素中,碳元素的两种同素异形体,石墨(graphite)和金刚石(diamond),及二氧化硅(SiO2)直接通过共价键形成macromolecule,而大部分电负性差值较小或为0的元素通过共价键形成小分子(simple molecule)后,再通过分子和分子之间的作用力才能形成giant covalent structure,这种作用力就是分子间作用力(intermolecular force)。
在AS部分中,我们会学习三种分子间作用力,伦敦色散力London force(CIE教材中称为范德华力Van der Waals’ force),偶极-偶极作用力(permanent dipole-dipole force)和氢键(hydrogen bonding)。
伦敦色散力London force /Van der Waals’force
当分子相互接近时,由于每个分子中的电子不断运动和原子核不断振动,经常发生电子云和原子核之间的顺势相对位移,也即正、负电中心发生了瞬时的不重合,从而产生瞬时偶极(instantaneous dipole)。而这种瞬时偶极又会诱导临近分子也产生和它相吸引的瞬时偶极。
影响伦敦色散力的主要因素有:
1、分子中的电子数
分子中电子数越多,电子云形变能力越强,分子间的伦敦色散力就越大。分子中的电子数变化通常由相对分子量表示。一般来说,相对分子量越大,分子内所含的电子越多,即伦敦色散力(London force)越强。例如卤族元素(halogen)随着周期数增加,单质熔沸点逐渐升高就是因为伦敦色散力由于相对分子量变大而逐渐变大。
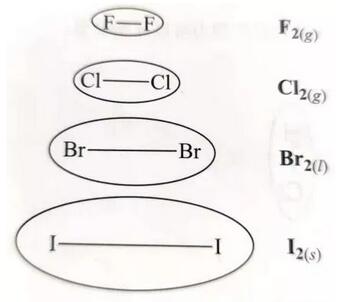
2、分子与分子间接触点数目
分子与分子间接触点越多,分子与分子间相吸引产生的瞬时偶极越大,伦敦色散力(London force)越强,因此熔沸点越高。
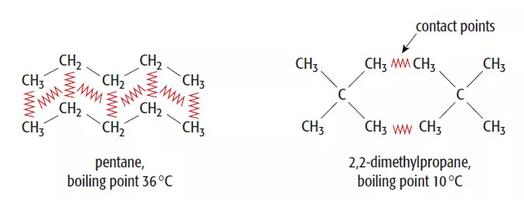
虽然瞬时偶极存在时间极短,但上述情况在不断重复,使得分子间始终存在引力。因此无论对于极性分子(polar molecule)还是非极性分子(non-polar molecule),伦敦色散力(London force)都始终存在,但相较于另两种分子间作用力,伦敦色散力总体强度较弱,这也是伦敦色散力的两大特征:
1. 存在于所有分子中(Exist in all molecules, no matter it’s polar or non-polar.)
2. 相对来说,是最弱的分子间作用力,除非分析的是分子量较大的长链有机物。
偶极-偶极作用力Permanent dipole-dipole force
这种力存在于极性分子和极性分子之间。由于极性分子(polar molecule)中原子的电负性(electronegativity)不同,形成共价键的电子对(bonding pairs)会偏向电负性大的原子一段,导致正负电荷中心不重合,使电负性大的原子带部分负电荷,电负性小的原子带部分正电荷,形成偶极permanent dipole。当两个polar molecule相互接近时,它们permanent dipole的同极相斥,异极相吸,两个分子间产生相互吸引力,例如两个HCl分子间相互吸引。

氢键Hydrogen bonding
氢键是一种特殊的偶极-偶极作用力,但氢键比一般的分子间作用力要强很多。氢原子与电负性大的三种原子,氮、氧、氟结合时,共用电子对几乎完全偏向了电负性大的原子(N.O.F),此时氢原子具有很大的正电性,在和另一个分子中电负性大的原子(N.O.F)接近时,这些氢原子会和电负性大的原子相互吸引,产生氢键。氢键是最强的分子间作用力。下图分别为H-O,H-N,H-F之间的氢键示意图。
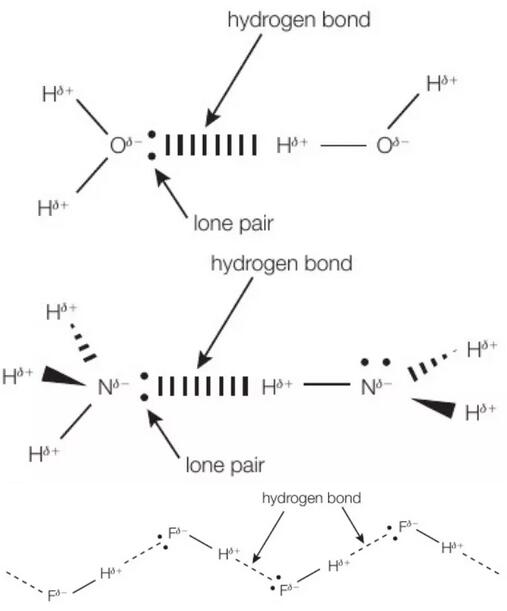
形成氢键需要两个必要因素:
1. 分子中同时存在H和氮氧氟(N.O.F)中的一种元素
2. 在分子内部,H直接与N或O或F相连
氢键的特征:
1. 较为少见,只在符合上述两个必要因素时出现
2. 是最强的分子间作用力,可以明显提高物质的熔沸点。
分子间作用力作为AS中的高频考点,常见的问题种类是通过比较分子间作用力大小比较两种物质熔点的高低。
对于这类比较熔点的题目,我们首先要做的是判断分子间作用力是否是影响熔点高低的主要因素,判断流程图如下。
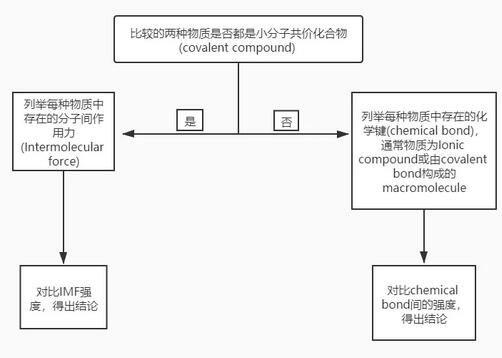
只有当进行熔点对比的物质均为共价化合物中的simple molecule时,物质熔点差异才是由分子间作用力引起的。
通用解题步骤
在确定需要使用分子间作用力进行判别后,在答案中我们要依次涉及这几个得分点:
1、列举每种物质中含有的分子间作用力种类
从London force/Van der Waals’ force, permanent dipole-dipole force, hydrogen bonding中选择物质所具有的力。
2、比较分子间作用力的强度
通常来说hydrogen bonding最强,大于permanent dipole-dipole force,大于London force/Van der Waals’ force;
London force/ Van der Waals’ force中相对分子量越大,力越大。
3、得出结论
例题
对于这道例题,我们就可以用上面的步骤进行回答。
1. ICl中含有的分子间作用力有London force,同时由于I和Cl在electronegativity上有差异,所以I与Cl中形成permanent dipole,即具有permanent dipole-dipole force;Cl2中只存在London force。
2. ICl中存在permanent dipole-dipole force,而Cl2中不存在;ICl由于相对分子量比Cl2更大,所以London force更强。因此总的来说ICl中的分子间作用力比Cl2中更大。
3. 由于ICl中分子间作用力比Cl2更大,所以ICl熔点比Cl2高。
我们再把这三点连起来写成一段话即可。
总结一下本题解答方法:
列举每种物质中含有的分子间作用力→比较不同分子间作用力强度,及两种物质伦敦色散力强度→分子间作用力强的熔点高
更多有关于A-Level科目及考试等方面的信息,大家也可以扫码关注锦秋A-Level进行了解,锦秋A-Level学院紧抓中国学生理科优势,进行课程组合化。开设数学、物理、化学、生物、经济学、会计学等课程,帮助学生以优异成绩申请更好的大学。

| 大学名称 | QS排名 |
|---|